200以上 質量 パーセント 濃度 301755-公式 質量 パーセント 濃度 求め 方
「 質量パーセント濃度 」は、 溶液のグラムのうちの、どれだけが溶質のグラムかを 表した濃度です。 例えばクラスの中で男女の比率を考える時、 男子の比率は「男子の人数÷全員の人数」、 女子の比率は「女子の人数÷全員の人数」とすれば良さそうです。 このように一番単純に濃度を考えたのが、 質量パーセント濃度です。 理学部や工学部の「女子パーセント濃度」は2%くら 質量パーセント濃度(重量パーセント濃度)といいます。 単位:w/w% wt% mass% 単位が%だけの場合、この質量パーセント濃度を指すことが多いです。 ② 嵩(かさ) 溶けている物の嵩mL ÷ 全体の体積mL で表し、 質量パーセント濃度98%、密度184g/cm 3 の濃硫酸(分子量98)のモル濃度を求めよ。 とりあえず密度と分子量を使って計算式を立てる。 基本これを計算すれば終了だが、今回は 質量パーセント濃度の記載があるのでそれを掛ける。

4 6 溶液の濃度 おのれー Note
公式 質量 パーセント 濃度 求め 方
公式 質量 パーセント 濃度 求め 方- 質量パーセント濃度とは 次は”質量パーセント濃度”にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。(質量パーセント濃度 から転送) 出典 フリー百科事典『ウィキペディア(Wikipedia)』 ( 0328 UTC 版) 濃度 ( のうど ) は、従来、「溶液中の溶質の割合を濃度という、いろいろな表し方がある。 質量パーセント濃度、モル濃度等」(日本化学会編 第2版標準化学用語辞典)と定義されて




質量パーセント濃度
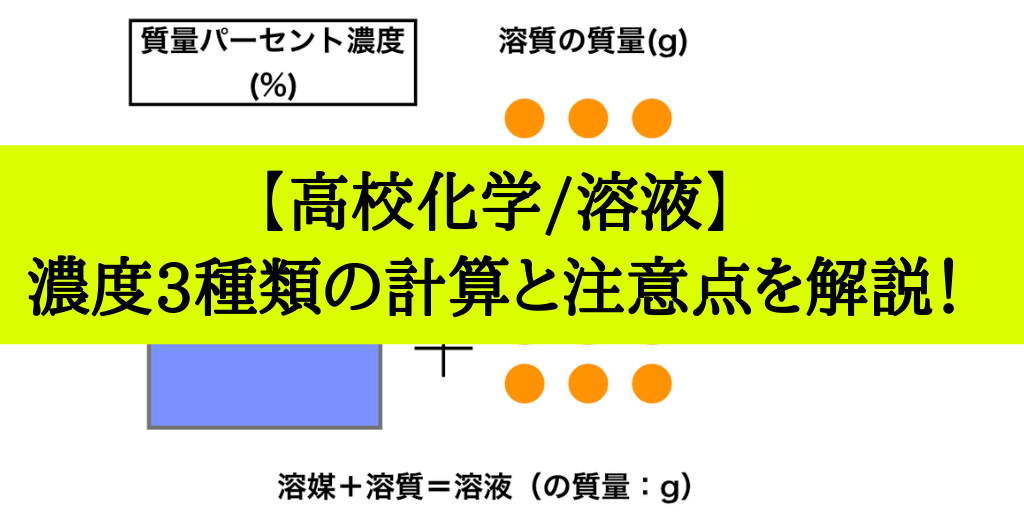
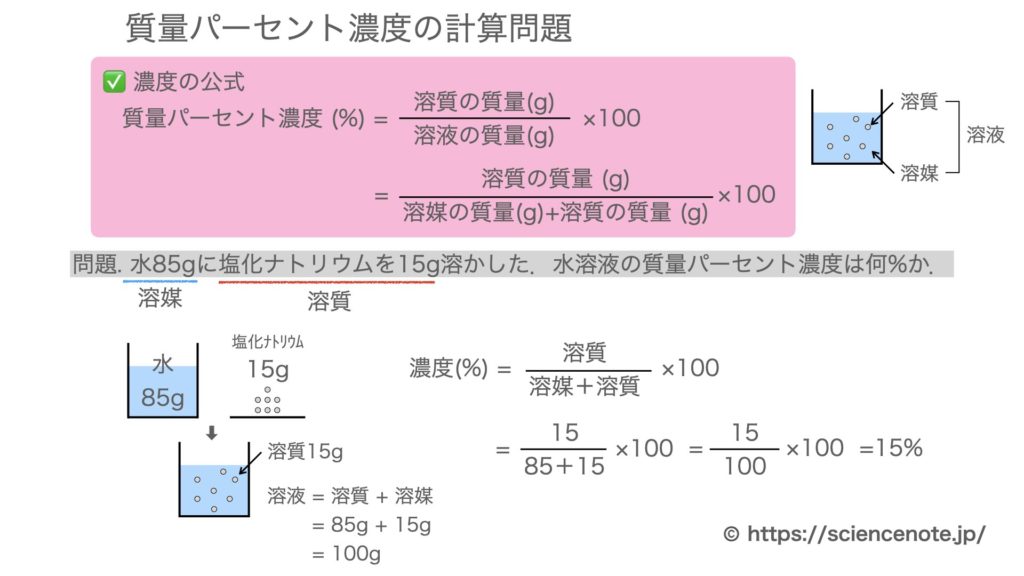
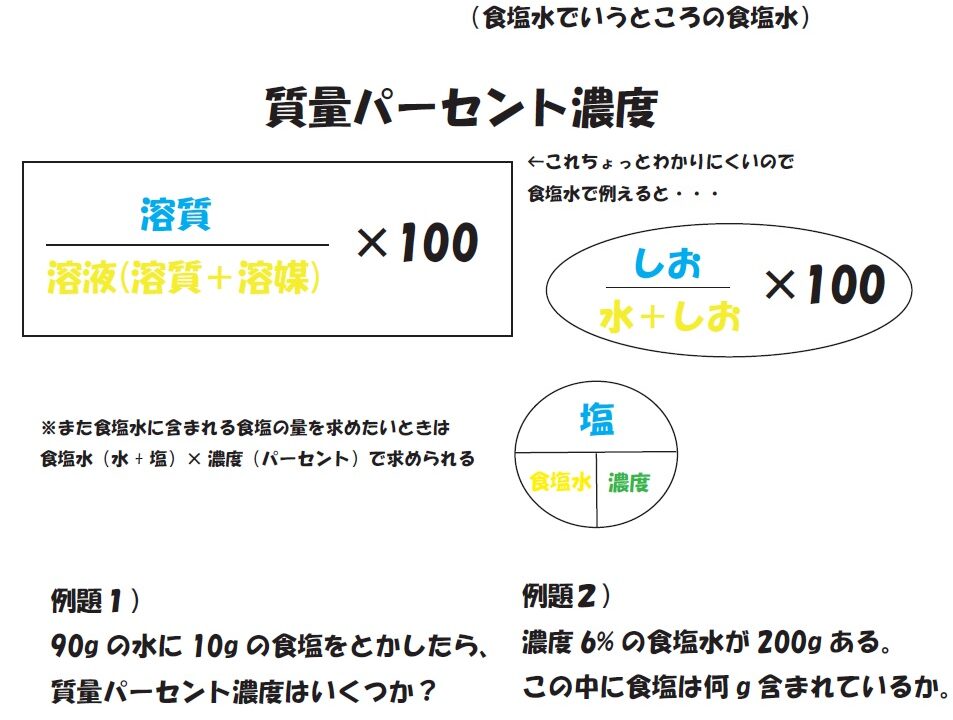
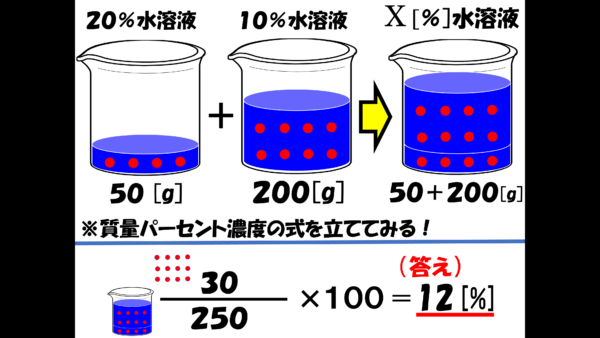
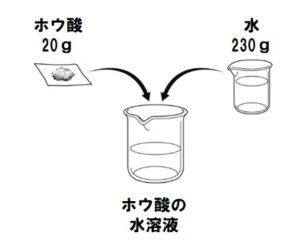
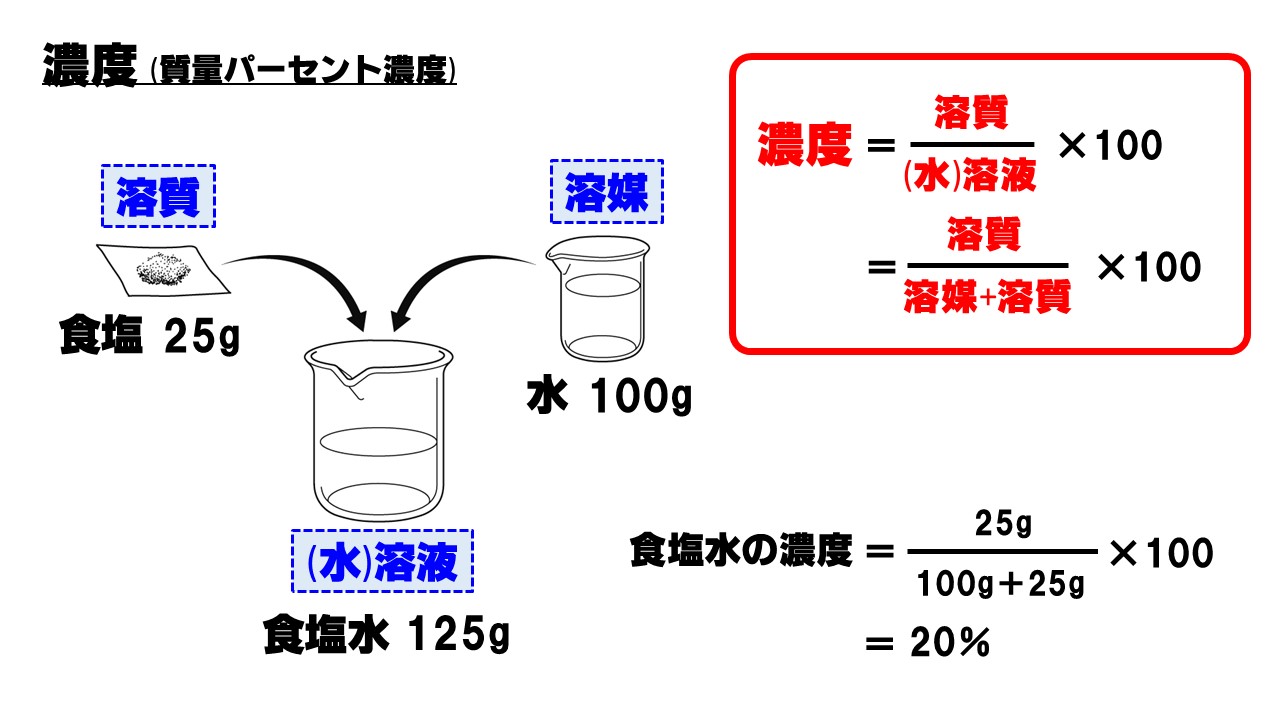
質量パーセント濃度の求め方練習問題 水100gに食塩を25g溶かした水溶液の質量パーセント濃度を求めよ。 答えはこちら 水100gと食塩25gを混ぜるのだから、完成した食塩水は となります。 よって、溶液125g、溶質25gとなるから 水340gに塩を60g溶かした質量パーセント濃度 をどのように求めるかというと、次の式に当てはめます。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100 では、実際に計算してみましょう。 溶液の質量は250gで、溶質の質量は50gです。 このことから、質量パーセント濃度は、次のようになります。 (50/250)×100=% よって、答えは、 「%」 となります。ハードル2:パーセントは単位ではない 6:左は濃度005、右は濃度0048でよい(質量で比較した濃度) → 濃度にパーセントをつける必要はない → しかし、より分かりやすくするためにパーセントという接尾語をつける
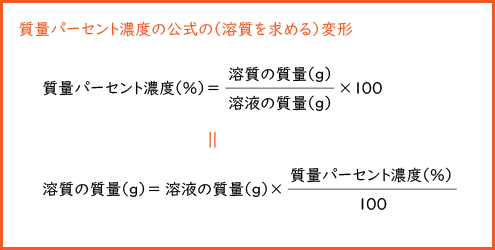
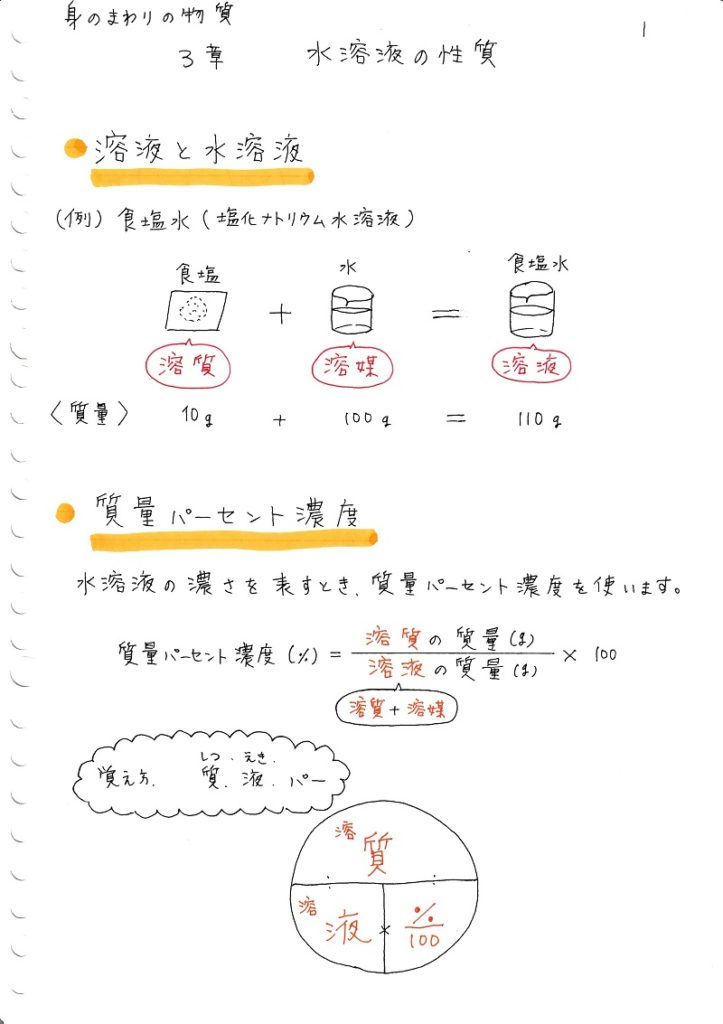
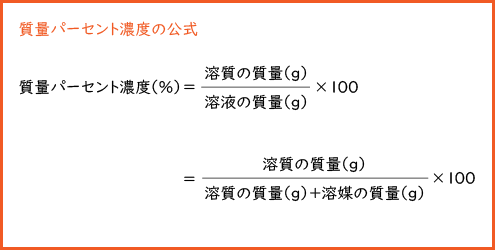
質量パーセント濃度 水溶液の質量に対する溶質の質量の比を水溶液の濃度といい、濃度を百分率(%)で表したものを質量パ-セント濃度といいます。 <求め方> 質量パーセント濃度(%)=(溶質の質量(g)/水溶液の質量(g))×100 (※水溶液=水+溶質) 溶解度と質量パーセント濃度の練習問題 問題1 まずは、一問一答から。 次の( )にあてはまる適語を答えよ。 (1) 質量パーセント濃度 質量パーセント濃度 とは、その名の通り質量を使って求めた濃度です。 単位は%を使います。 溶液の質量に対して溶質が何g溶けているかを百分率で表したもの です。 次の計算式で求めることができます。質量パーセント濃度 % = 溶液の質量 g = 溶媒の質量 g 溶質の質量 g
質量パーセント濃度とは 質量パーセント濃度とは、溶質の質量 gを溶液全体の質量 gで割って100をかけたものです。 以下公式です。 質量パーセント濃度 % 溶質の質量 g 溶液の質量 g 質 量 パ ー セ ン ト 濃 度 % = 溶 質 の 質 量 g 溶 液 の 質 量 g × 100 密度とは 密度とは、溶液全体の質量 gを溶液全体の体積 Lで割ったものです。 以下公式です。 $$密度 g/cm^3 =質量パーセント濃度とは、質量濃度の単位 w/wの代わりに 100分率記号にweightを略したwtをつけ、 wt% を用いて表す単位を使う。 単に%を使うことがあるが、容量パーセント濃度と混同されかねないため、正式ではない。 質量パーセント濃度は、その指数を使って簡単に溶質の量を計算できるほか、濃度の大きさを直感的に扱うことができるため、大まかな濃度を示したいときなど、多くの場質量パーセント濃度 質量パーセント濃度(%)= 溶質の質量(g) 溶液の質量(g) ×100 例 90gの水に10gの塩化ナトリウムをとかしたら、 100gの塩化ナトリウム水溶液になる。 このとき 溶質10g, 溶液(溶媒溶質)100gなので 濃度は




中学1年の理科 動画 質量パーセント濃度の問題 水溶液 19ch




中1 理科 中1 32 質量パーセント濃度 Youtube
このとき、質量パーセント濃度の公式で方程式をつくると、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 10 = x ÷(x 180)×100 x = g になるね! つまり、質量パーセント濃度10%のココアをお湯180gで作るためには、 ココアの粉をg混ぜればいいってことさ。 練習問題4 「溶媒の質量を計算する問題」 質量パーセント濃度%の濃い抹茶を飲んで さて、質量パーセント濃度とはいったい何なのでしょうか? 質量パーセント濃度とは 「ある溶液中に溶けている溶質の割合」 を示します。 ここで語句のチェックです。 ・溶液液体に物質が溶けたもの ・溶質溶液に溶けている物質 ・溶媒溶質を溶かしている液体 白枝先生 特に 溶媒が水である溶液 のことを 「水溶液」 と言います。 理科の実験で使用するものはたいてい水溶液な質量パーセント濃度〔%〕= (溶質の質量〔g〕/水溶液の質量〔g〕)×100 さて、この水溶液全体の質量がわかりました。 しかし、今求めたいのは、水に溶けている水酸化ナトリウムのモル濃度です。 必要なのは水酸化ナトリウムの質量であり、水は邪魔ですよね。 ですから、水溶液全体10gのうち、 溶質の質量 はいくらか求めましょう。 このときに使うのは、質量パーセント濃度です。 質量パーセ




中学理科 水溶液の性質 ママ塾ノート




腎臓 計算に必要な基礎知識 濃縮率の求め方 せいぶつ農国
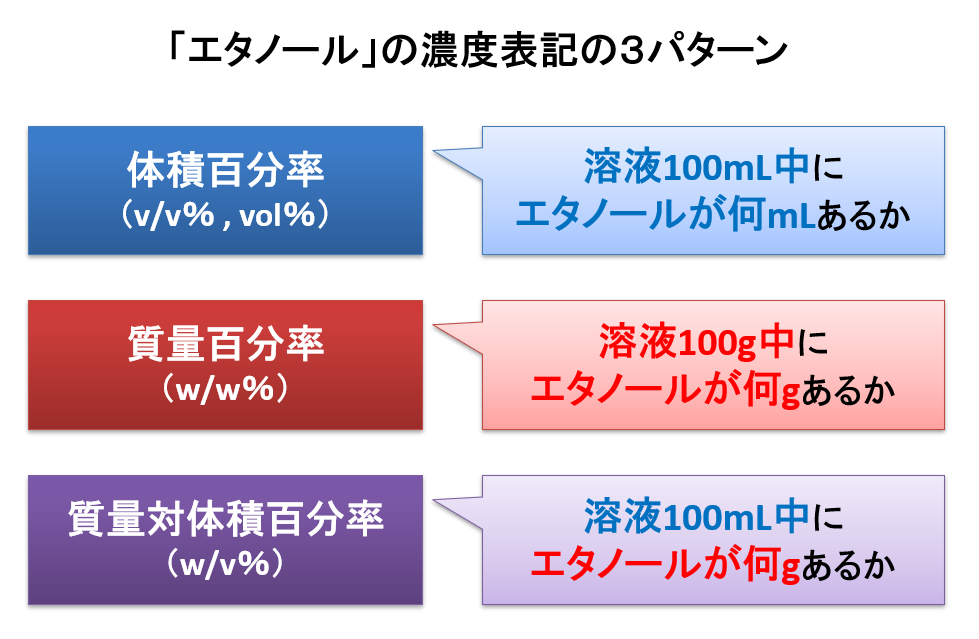
mol%とは「物質量(モル)で考えたときの濃度」のことです。 mol%は「モルパーセント」と読むことが多いです。 モルパーセントは、 溶質 (溶かしている物質)のモル ÷ 全体のモル で計算できます。 例えば、2mol の物質Aと、8mol の物質Bを混ぜてできた混合液における、物質Aのmol%は、 2 ÷ 10 = 02 つまり mol% になります。 ※mol%よりも、 m o l / L という単位(1質量パーセント濃度 = 溶質 (g) 溶液 (g) ×100より、 60 160 ×100=375 2 (1)答 10g 240g 解説 ① 溶質= 質量パーセント濃度 100 ×溶液より 4 100 × 250 =10 ② 溶媒 = 溶液 溶質 より =240 (2)答硝酸カリウム50g、水350g 解説 溶質= 質量パーセント濃度 100 ×溶液より 125 100 ×400 = 50 溶媒 = 溶液 溶質 より 400 50 = 350 (3)答7g 解説 水をxgとして方程溶質の質量g 溶液の質量g ×100 で表す。 w/v% は,質量体積パーセント濃度,若しくは質量容積パーセント濃度といい,分子が溶質 の質量 gで分母が溶液の体積mL の場合であり,w/v% = 溶質の質量g 溶液の体積mL ×100 で表す。 v/v% は,体積パーセント濃度



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




モノマナビ研究所
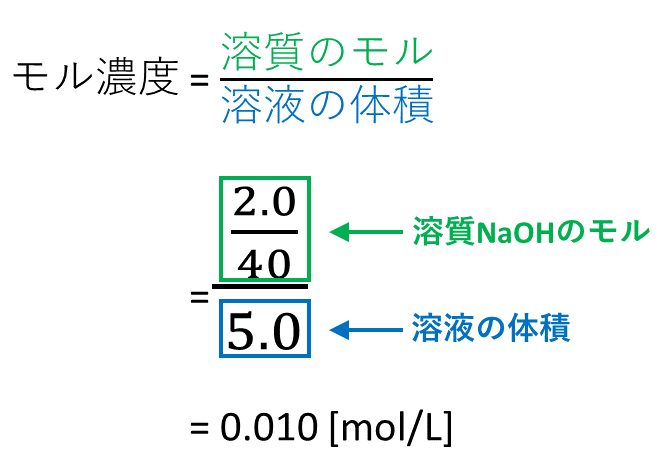
モル濃度とは、溶質のモル (mol)/溶液の体積 (L)で表される、入試必出の知識です。 本記事では、溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性について、図と入試頻出の練習問題でわかりやすく解説します 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だ。 もうちょっと簡単に言ってあげると、 「溶かす物質の重さ」を「溶けてできた液体の重さ」で割って「100」をかければいいんだ。 つまり、質量パーセント濃度とは、 「溶かした物質の重さ」が「溶けてできた液体全体の重さ」のうち何パーセントをしめるのか? を表 質量パーセント濃度 質量パーセント濃度は溶液 100g に含まれる溶質の質量(g)のこと。単位は%で表す。 例えば 36% の水酸化ナトリウム水溶液 100g には、36g の水酸化ナトリウムと 64g の水が含まれています。



中学1年生理科 質量パーセント濃度 成果主義 Itto個別指導学院 長野市の学習塾




溶液の濃度 無料で使える中学学習プリント
質量/体積(容積)パーセント濃度の求め方 溶質の質量 (g) ÷ 溶液の体積・容積 (ml) × 100 = 質量/体積パーセント濃度 % 体積(容積)ml にしめる、溶質の割合を求める方法です。 質量パーセント濃度は、溶液 100g に占める溶質の割合を求める方法ですが、 質量/体積パーセント濃度の場合は、100ml の体積(容積)にしめる溶質の割合を求める方法です。 注意しなければならないのは、溶質の種質量パーセント濃度(%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100 これは、溶液の中に溶けている溶質が全体の何パーセントかということです。食塩水で例えると食塩水(g)中に食塩(g)が何パーセント含まれているかを表しています。 質量パーセント濃度の計算 質量パーセント濃度の計算を行う前に、濃度の求め方を復習しましょう。 質量パーセント濃度 = 溶質 / 溶液 ×100 質量パーセント濃度 = 溶質 /(溶媒 + 溶質) ×100 要するに、水溶液全体の質量に対し、溶けている溶質が何%なのかを求めているだけです。




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



Www Jupiterimages Com
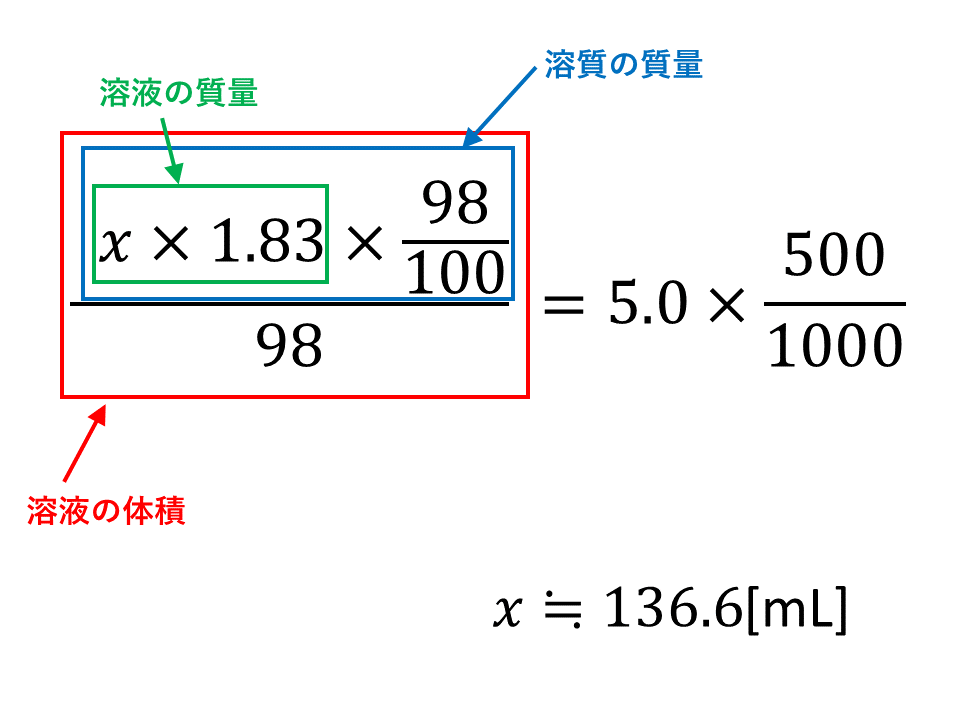
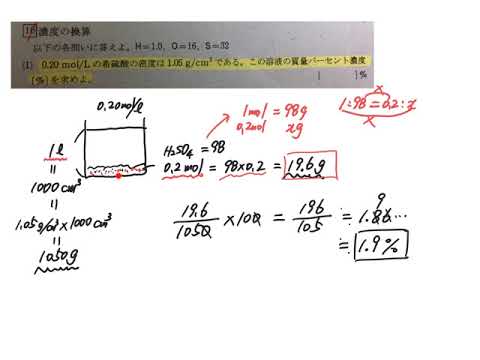
wt%とは何か? wt%とは、 重量パーセント濃度 のことです。 wtは重量weightの略で、%は百分率を表しています。つまり、 溶質の重量が全体の重量に対して、どのくらいあるかを百分率で表した数値 です。 ポイントは重量で計算しているところです。 質量パーセント濃度は、 (98÷1840)×100=053% となる。 ※小数第3位を四捨五入した。 質量パーセント濃度からモル濃度への変換も同じことである。 この場合、最初に1lあるとして計算するとよい。 質量モル濃度の考え方 さて、3番目の質量モル濃度は、 解答・解説質量パーセント濃度の計算特訓 (1)% 溶質(食塩)25gと溶液(食塩水)125gなので、 25/125 ×100=% (2)% 溶質(食塩)50gで溶液(食塩水)は、0+50=250gなので、 50/250 ×100=% (3)36g 溶液(食塩水)300gの12%が溶質(食塩)なので、 300×012=36g (4)1g 質量パーセント濃度が%なので、溶液(食塩水)




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube
濃度を示す指標として 質量パーセント濃度 があります。これは、溶液100g中に溶質がどれだけ溶けているかを示すものです。 式で表すと、 質量パーセント濃度=溶質÷溶液×100 となります!後ろに100を掛けているのは、出てきた値を百分率で表したいからです。 質量パーセント濃度0%の水酸化ナトリウム水溶液の密度は12g/cm3である。この水溶液のモル濃度を求めよ。 原子量H=10 O=160 Na=230とする。 という問題のわかりやすい解き方の順序を教えて下さい。 宜しくお願い致します。 質量パーセント濃度を求めるには、公式にあてはめれば一瞬。 質量パーセント濃度は 15% でした。 食塩水が100gあれば、その中に15gの食塩が溶けているくらいの濃さ、ってことです。 ちなみに、とても塩辛い海水でさえ、食塩で考えた質量パーセント濃度は 3~4% です。 つまり、15%の食塩水は塩辛すぎて体に危険。 例えば、 1歳児は4~5g (スプーン1杯くらい)の食塩を食べる




質量パーセント濃度 塾の質問箱



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine
「質量パーセント濃度」 溶液の質量に対する溶質の質量の割合を 百分率で示したもの 求め方 質量パーセント濃度(%) 溶質 の質量(g) = × 100 溶液 の質量(g) 溶質の質量(g) = × 100 溶質の質量(g)+溶媒の質量(g) もちろん、実際のテストでは、 「砂糖水」 や 「食塩水」 など、 具体的な溶液 を使うので、 “溶質が” “溶媒が” と、悩質量パーセント濃度を学ぶためには、まず 「溶媒(ようばい)」「溶質(ようしつ)」「溶液(ようえき)」 という3つの言葉を確実に覚えなくてはいけません。 ある液体に他の物質を混ぜてるとき、物質をいれる液体の方を「溶媒」、混ぜ合わせる物質質量パーセント濃度 溶液の濃度の表し方の1つである質量パーセント濃度ですが、中学の理科で習った濃度ですね。 溶液中の溶質の割合をパーセント(%)で表します。 溶液は溶媒と溶質を足したものなので全体が溶液ですから、溶質と溶媒を別々に考えられるようになると良いですね。 濃度自体は溶媒の量は気にせず求まりますので先ずは計算式は覚えておきましょう。 質量パーセント濃度 溶質の



水溶液と質量パーセント濃度の計算問題 Hiromaru Note



モル濃度 Okedic
パーセント濃度は、溶質の質量÷溶液の質量×100です。 <数式の挿入> ②で求めた溶質の質量÷①で求めた溶液の質量×100で求められるので、<数式の挿入> 438 ÷ 10 ×100= 365% <数式の挿入> これより、求める質量パーセント濃度は365%となります。 確認問題 大まかな計算の手順①②③を元に、実際に問題を解いてみましょう。 いきなりノーヒントで解くのは難し




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月




至急 質量パーセント濃度が98 の濃硫酸の密度は1 8g Cm3である この 高校 教えて Goo




H30 1 4 4 質量パーセント濃度 On Vimeo



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




高校受験対策 理科 質量パーセント濃度 熱量 の問題 動画 19ch




質量パーセント濃度 基準を統一する科学者たち Menon Network



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




質量パーセント濃度 Explore Facebook




質量パーセント濃度
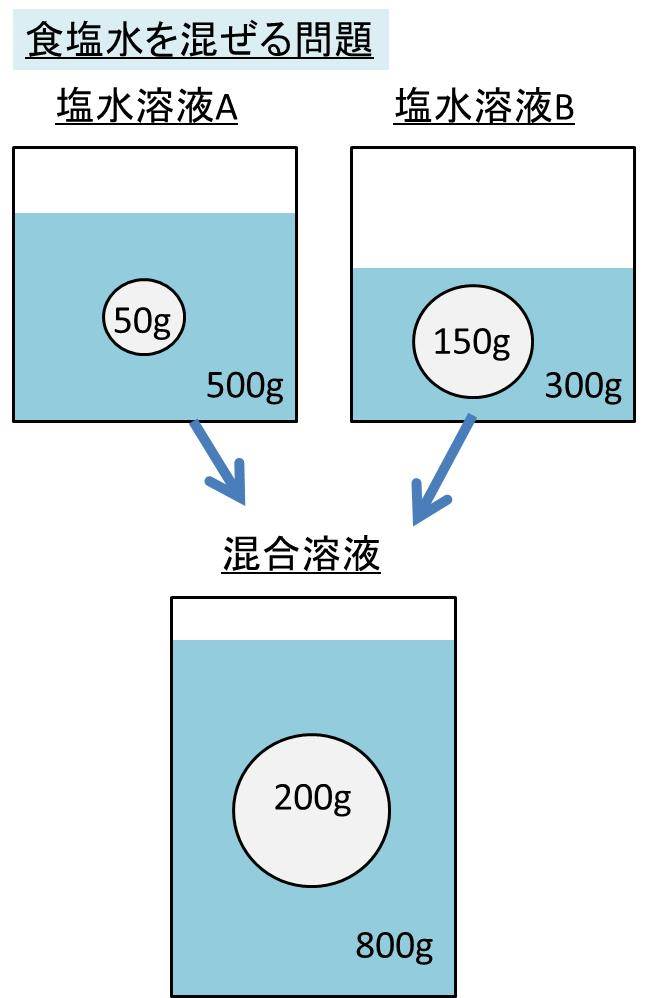



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



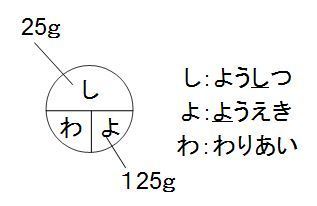
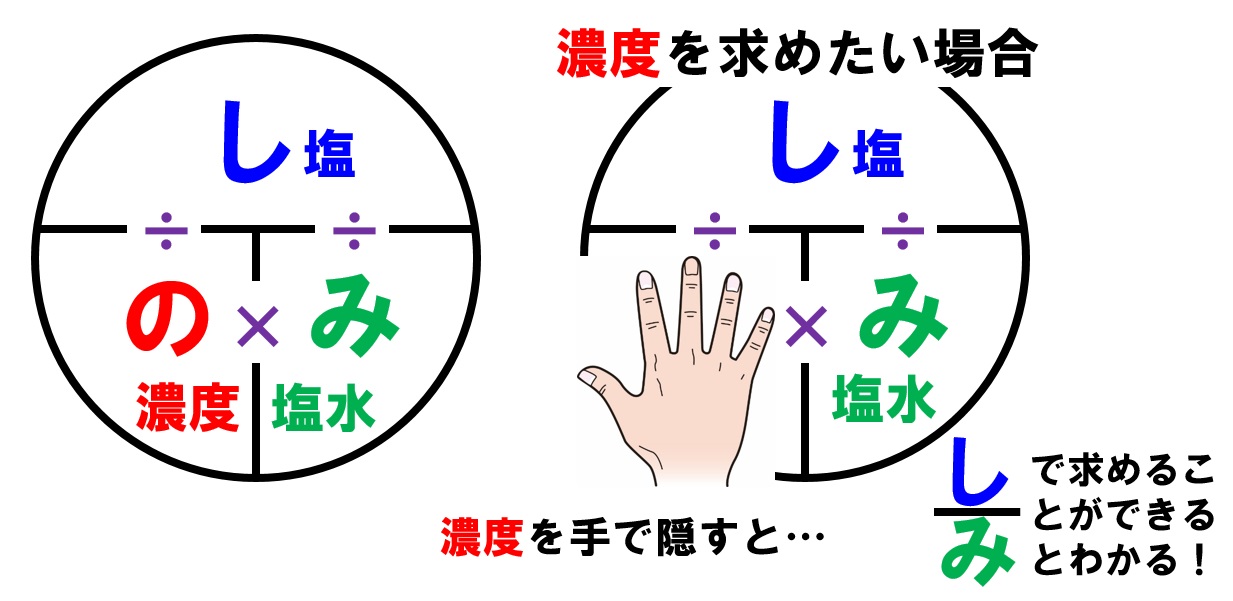
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋




モル濃度から質量パーセント濃度に変えることは可能ですか Clearnote
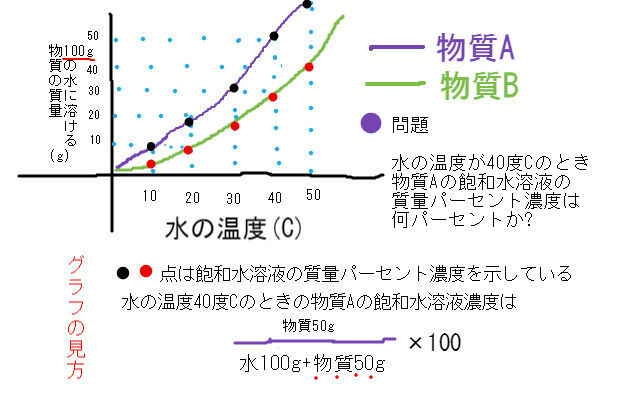



グラフを使った水溶液濃度の問題 中学 数学 理科の復習サイト




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




Akiya Su 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度 T Co Tri1p3fn72 Twitter




12月10日更新 第36回 高校入試をみる 2020年度青森県 理科 4 成績 上がってます 根城学習塾 八戸市




6 7 モル濃度と密度から質量パーセント濃度を計算します 1lあったとしたら と仮定すれば あとは簡単です プレテスト化学基礎 第3問 問3 Youtube




質量パーセント濃度 Twitter Search Twitter



モル濃度 質量パーセント濃度 質量モル濃度 濃度計算のコツも解説 受験メモ




モル毎リットル 単位プラス 大日本図書



中学1年生理科 質量パーセント濃度 プリント ブリッジぷりんと




4 6 溶液の濃度 おのれー Note



濃度の応用



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する



中学理科 水溶液の性質 ママ塾ノート




質量パーセント濃度の計算問題集 基本編 Menon Network



質量パーセント濃度の求め方ってこれであってますか 質量パーセ Yahoo 知恵袋




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす



3



質量パーセント濃度 Okedic



1




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中学校理科 物質の水への溶け方 30 32 水溶液とイオン 水溶液の濃さを数値で表そう 水の量と溶かした物質の量から質量パーセント濃度を求めて 化学変化とイオン トップへ
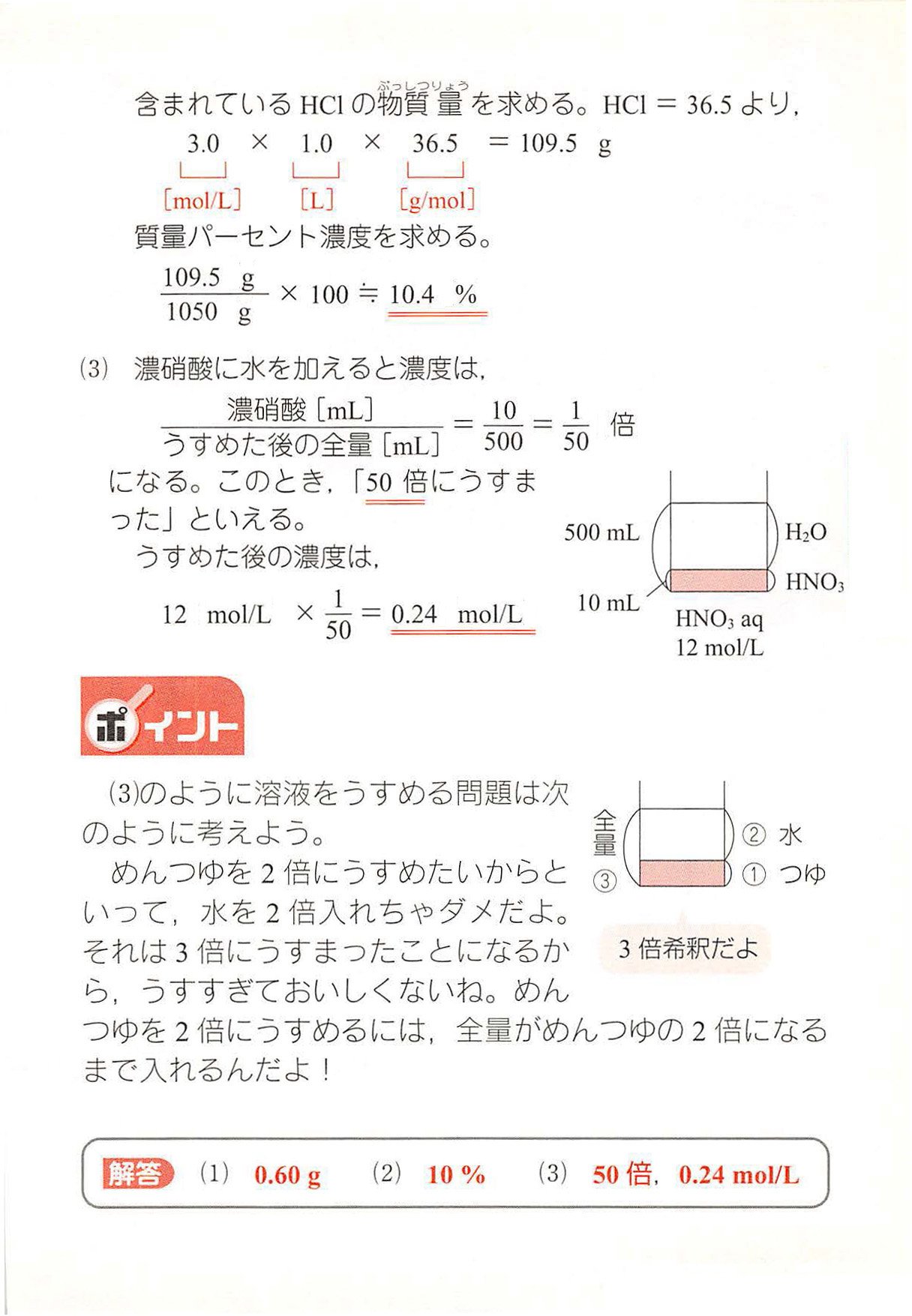



西村能一 科学の名著50冊が1冊でざっと学べる Kadokawa 化学計算問題 6 濃度 G Mol Lを求める 1 0 10 Mol L酢酸ch Cooh水溶液100 Mlに酢酸は何g溶けているか 2 3 0 Mol Lの塩酸 密度1 05g Cm の 質量パーセント濃度は何 か 3 12



危険物資格取得のための高校化学no 2 濃度計算 F M サイエンスブログ




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



モル濃度の計算 化学の大村 私立中高一貫校 化学科教員 Note



中学1年生理科 質量パーセント濃度 成果主義 Itto個別指導学院 長野市の学習塾



1




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく



中1理科 質量パーセント濃度の定期テスト過去問分析問題 ダイスト



気体の溶解度



食酢の質量パーセント濃度ってどうやって求めるんですか C 1 Yahoo 知恵袋



中1理科 濃度 質量パーセント濃度 のポイント Examee




質量パーセント濃度の計算問題集 応用編 Menon Network




理科の質量パーセント濃度の計算です Clearnote



消毒用エタノールの濃度 Vol W W W V の区別と 日本薬局方 消防法の規程 消毒効果と濃度換算 お薬q A Fizz Drug Information



質量パーセント濃度中1です 理科の質量パーセント濃度が解けませ Yahoo 知恵袋




化学 6回目授業 ブログ De 授業 21



質量を持った残像




質量パーセント濃度計算ページ サイト上で動作 結果をグラフ化 カガクなキッチン



化学 Mol濃度 質量パーセント濃度 Youtube




質量 パーセント 濃度 求め 方 質量パーセント濃度 計算問題 Luismiguel Pt




化学勉強法 センター試験09 Mol濃度から質量パーセント濃度へ 大村の化学勉強法



基礎化学3 溶液




質量パーセント濃度の求め方とモル濃度の違い




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく
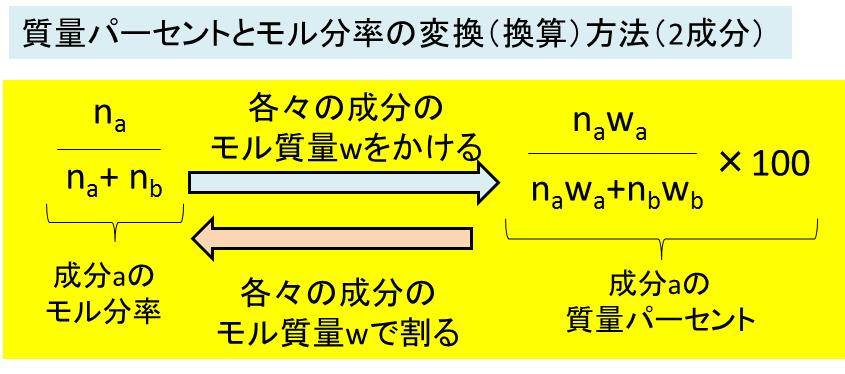



質量パーセントとモル分率の変換 換算 方法 計算




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット




濃度について 質量パーセント W W と質量体積パーセント W v 生涯学人 まなびと 楽しいサイエンス 暮らしはサイエンス 子供たち サイエンスを感じて




溶液の濃度に関する問題 完全攻略チャート 過去問解説集 自宅でできる受験対策ショップ ワカルー Wakaru




Junior High理科的質量パーセント濃度 筆記 Clearnote
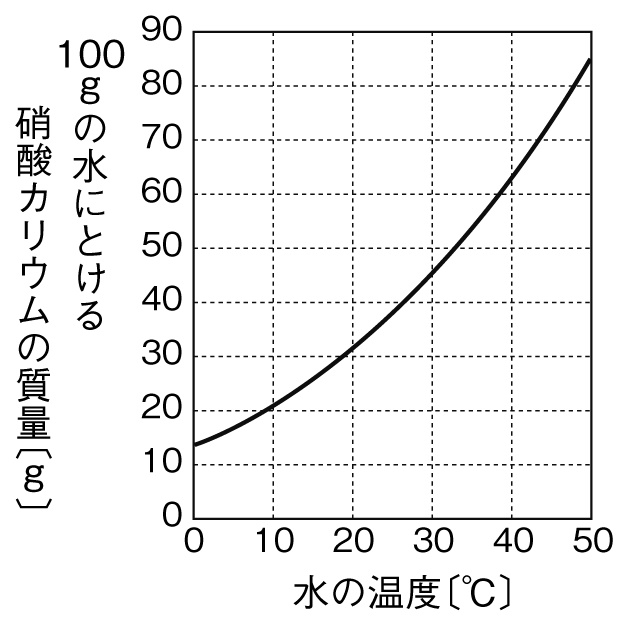



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee




理科 質量パーセント濃度の人気動画を探索しましょう Tiktok




質量パーセント濃度




演習問題 問68 薬がみえるvol 4




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ



溶質を求める




モル濃度と質量パーセント濃度の計算 問題と答え 大学受験の王道
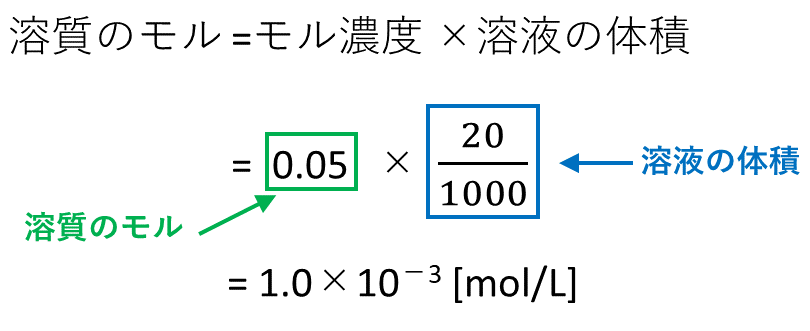



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




質量パーセント濃度の問題を計算したのですが どうやっても答えになり 中学校 教えて Goo



公式を使う




この問題の 3 の解き方をわかりやすく教えてください Clearnote




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




質量パーセント濃度が6 の食塩水150gに水を50g加えてできる食塩水の質 Clearnote




理科 中1 27 質量パーセント濃度 Youtube




質量パーセント濃度 Okedic




質量パーセント濃度 1




溶解度曲線に関する問題集 Menon Network
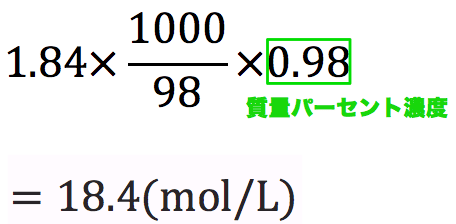



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
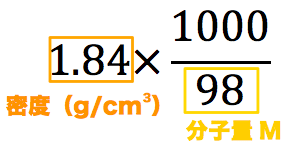



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット




原子百分率の計算方法 備忘録 T Nakaの阿房ブログ
コメント
コメントを投稿